Acides aminés
Acides aminés : les petites briques de la vie
Les acides aminés sont de petites molécules organiques qui jouent un rôle crucial chez tous les êtres vivants. Ils sont les éléments constitutifs de la totalité des peptides et des protéines, et possèdent de nombreuses autres fonctions. Certains acides aminés agissent comme des molécules messagères et d’autres sont des précurseurs d’autres substances importantes telles que les neurotransmetteurs et les hormones.
On pourrait décrire les protéines comme les « molécules de travail » de l’organisme. Elles permettent pratiquement tous les processus biochimiques. Parmi les protéines, on peut citer l’hémoglobine, qui transporte l’oxygène dans le sang ;
-
L’hémoglobine, qui transporte l’oxygène dans le sang.
La kératine, qui constitue la majeure partie des cheveux et des ongles et qui, avec les protéines collagène et élastine, est essentielle à la structure et aux fonctions de la peau.
L’actine et la myosine, responsables de la contraction musculaire.
Les récepteurs et canaux ioniques qui transmettent les signaux.
Les anticorps du système immunitaire.
-
Les enzymes qui décomposent les nutriments et facilitent les réactions biochimiques vitales.
Comme les protéines, les peptides sont essentiels à la vie et possèdent de nombreuses propriétés différentes, notamment antimicrobiennes, antivirales, immunomodulatrices et anti-inflammatoires1.
Au total, il existe 20 acides aminés standard qui sont communs à toutes les formes de vie sur Terre et qui sont codés directement dans le matériel génétique : l’ADN. De plus, des acides aminés particuliers tels que la sélénocystéine et la pyrrolysine peuvent être incorporés dans les protéines chez l’Homme par des mécanismes spéciaux, et les acides aminés de différents organismes sont également très variés. Plus de 300 acides aminés différents ont été identifiés dans la nature. Parmi les 20 acides aminés standard, certains sont essentiels pour l’Homme et doivent être apportés par l’alimentation.
D’autres sont conditionnellement essentiels – également appelés semi-essentiels – et nécessaires sous certaines conditions, tandis que les autres sont non essentiels, car l’organisme peut les synthétiser dans une mesure suffisante. Les bonnes sources d’acides aminés dans les aliments sont la viande, les œufs, le poisson, les produits laitiers et les légumineuses.
Les acides aminés jouent de nombreux rôles dans la nature, et sont également largement utilisés dans divers produits et industries, notamment dans l’alimentation humaine et animale, les médicaments, les compléments alimentaires et les cosmétiques. En plus de leur utilisation directe en tant qu’acides aminés, ils servent aussi de point de départ pour la fabrication d’autres substances, par exemple des agents tensioactifs relativement doux (surfactants) et des ingrédients pour soins capillaires.
Sans les acides aminés, la vie sur Terre n’existerait pas : ce sont des éléments fondamentaux de la chimie de la vie. Ils sont essentiels à la formation des protéines, des peptides et de nombreuses autres substances vitales pour tous les organismes vivants connus.
PUCA PURE & CARE utilise les acides aminés arginine, proline et sérine dans ses produits, ainsi que l’acide aminé glycine pour produire le tensioactif relativement doux Potassium Cocoyl Glycinate, et plusieurs de ses produits contiennent des peptides et des protéines végétales hydrolysées.
1Pour en savoir plus sur les peptides, consultez le site
Acides aminés : découvertes et dogme central
La découverte des acides aminés remonte à plus de 200 ans. En 1806, un acide aminé a été isolé pour la première fois avec succès à partir d’asperges et la substance obtenue a été baptisée asparagine. Au cours des décennies suivantes, les autres acides aminés ont été progressivement identifiés et leurs structures chimiques cartographiées. Le dernier des 20 acides aminés standard, la thréonine, a été découvert en 1935.
Au début des années 1900, on s’est rendu compte que les protéines et les peptides étaient constitués d’acides aminés. Cette découverte a jeté les bases de la compréhension des protéines en tant que macromolécules biologiques et a constitué une étape importante vers ce qui est devenu plus tard le dogme central de la biologie moléculaire : l’information génétique contenue dans l’ADN est transcrite (réécrite) en ARN, puis transposée (traduite) en protéines.
Ce processus fondamental et énergivore commence par la transcription, lors de laquelle un gène de l’ADN cellulaire sert de modèle pour la production d’ARN messager (ARNm). L’ARNm est ensuite transporté vers les ribosomes – les usines à protéines complexes de la cellule – où a lieu la traduction de l’ARNm en chaîne d’acides aminés. L’ARNm est constitué d’une chaîne de nucléotides2, dont les quatre bases possibles portent le code génétique.
Ces quatre bases possibles sont l’adénine (A), la guanine (G), la cytosine (C) et l’uracile (U), qui sont lues par groupes de trois appelés codons.
Ainsi, un codon est une combinaison de trois des quatre nucléotides possibles, et il existe 64 codons possibles. Certains de ces codons agissent comme un signal d’arrêt dans le processus de traduction, tandis que la plupart des codons codent pour un acide aminé spécifique et qu’il existe plusieurs codons qui codent pour le même acide aminé, par exemple les quatre codons GCT, GCC, GCA et GCG codent pour l’acide aminé alanine, alors qu’il y a six codons qui codent pour l’arginine : CGU, CGC, CGA, CGG, AGA et AGG
La transformation (traduction) de l’ARNm en acide aminé se fait par l’intermédiaire des molécules d’ARN dites de transfert (ARNt), qui agissent comme un adaptateur : elles reconnaissent un codon spécifique sur l’ARNm et apportent l’acide aminé correspondant au ribosome. Là, les acides aminés sont reliés un à un par des liaisons peptidiques3, formant une chaîne qui est ensuite repliée et transformée en une protéine fonctionnelle.
2Les nucléotides sont les éléments fondamentaux de l’ADN et de l’ARN. Un nucléotide est constitué d’une molécule de sucre (désoxyribose dans l’ADN, ribose dans l’ARN), d’un groupe phosphate et d’une base azotée. Dans l’ADN et l’ARN, les nucléotides sont liés entre eux par de longues chaînes.
3Une liaison peptidique est la liaison qui existe entre chaque acide aminé lorsqu’ils se lient pour former des protéines. Cette liaison est une liaison amide entre le groupe acide carboxylique d’un acide aminé et le groupe amine d’un autre acide aminé.
Acides aminés : la structure chimique
Les acides aminés sont un groupe de biomolécules qui contiennent toutes deux groupes fonctionnels centraux : un groupe amino basique (-NH₂) et un groupe acide carboxylique (-COOH). Par ailleurs, chaque acide aminé possède une chaîne latérale, souvent appelée groupe R, qui varie d’un acide aminé à l’autre. C’est précisément ce groupe R qui confère à l’acide aminé ses propriétés particulières.
La position du groupe amino par rapport au groupe carboxyle détermine le type d’acide aminé. Si le groupe amino est attaché au même atome de carbone que le groupe carboxyle (l’atome C marqué par « α » dans la formule structurelle de la figure 1), il s’agit d’un acide alpha-aminé. Si le groupe amino se trouve sur un atome C plus éloigné du groupe acide carboxylique, on parle d’acides bêta ou gamma-aminés. En biologie et en chimie, lorsque l’on parle « d’acides aminés », il s’agit presque toujours d’acides alpha-aminés. Les 20 acides aminés standard que l’on trouve dans les protéines sont tous des acides alpha-aminés et c’est sur eux que nous nous concentrons ici.
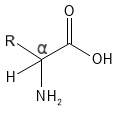
Figure 1 Structure chimique générale d’un acide alpha-aminé. Notez l’atome α-C marqué avec les quatre liaisons au groupe acide carboxylique (-COOH), à la chaîne latérale R, au groupe amine (-NH2) et à l’atome H, qui sont indiqués ici pour clarifier les quatre liaisons (normalement, l’atome H ne serait pas indiqué dans de telles formules structurelles).
Dans les acides alpha-aminés, l’atome de carbone alpha est généralement associé à quatre groupes/atomes différents : le groupe acide carboxylique, le groupe amino, la chaîne latérale (R) et un atome H. Il existe à cet égard deux acides aminés particuliers : la proline, dont le groupe amine et l’atome de carbone alpha font partie d’un anneau à cinq chaînons, de sorte que le groupe amine est une amine secondaire et qu’il n’y a pas d’atome H sur l’atome de carbone alpha, et la glycine, dont le groupe R est un atome H (et qui n’a donc pas d’atome de carbone alpha avec quatre liaisons différentes). À l’exception de la glycine, les 20 acides aminés standard peuvent former deux structures spatiales différentes qui sont des images miroir l’une de l’autre : les isomères L et D. En effet, l’atome de carbone alpha possède quatre liaisons différentes et agit donc comme un stéréocentre ; les deux isomères sont également appelés énantiomères. À l’exception de la glycine, qui ne possède pas de stéréocentre, les acides aminés dans la nature sont généralement des isomères L. Cependant, certains acides aminés D sont présents dans certaines bactéries, certains organismes marins et aussi chez l’Homme, où une petite quantité d’acide aminé D-sérine a été trouvée.
Au pH physiologique, qui se situe normalement entre 7,35 et 7,45 pour le sang et entre 7,0 et 7,4 à l’intérieur des cellules, les acides aminés se présentent généralement sous la forme de zwitterions, ce qui signifie que la molécule porte à la fois une charge positive et une charge négative. La charge positive se trouve sur le groupe amine (-NH3+), tandis que la charge négative se trouve sur le groupe acide carboxylique (-COO-). Dans la littérature spécialisée, on constate souvent des structures chimiques sans cette distribution des charges en fonction du pH.
Acides aminés : propriétés et classification
C’est la chaîne latérale des acides aminés qui leur confère leurs différentes structures chimiques et donc leurs différentes propriétés, qui se reflètent également dans les peptides et les protéines dont ils font partie.
Les acides aminés peuvent être classés de différentes manières en fonction de leurs propriétés. Les propriétés physico-chimiques comprennent leurs propriétés acido-basiques, leur charge, leur polarité et leur solubilité. La plupart des acides aminés sont solubles dans l’eau et généralement polaires, mais à des degrés divers selon la chaîne latérale. Certains acides aminés ont une chaîne latérale non polaire et hydrophobe, ce qui a son importance par rapport à leur position dans les protéines, par exemple. Comme cela a été dit plus haut, la plupart des acides aminés sont des zwitterions au pH physiologique, mais certains d’entre eux peuvent également avoir une charge dans leur chaîne latérale en fonction du pH de l’environnement et donc avoir une charge globale positive ou négative. Les groupes fonctionnels des chaînes latérales, tels qu’un groupe OH, un atome de soufre, un atome d’azote ou une structure en anneau, sont également importants pour les propriétés physico-chimiques et biologiques de l’acide aminé et de la protéine.
D’un point de vue nutritionnel et biologique, les acides aminés sont classés en trois catégories :
Les acides aminés essentiels que l’organisme ne peut pas produire lui-même (en quantité suffisante) et qui doivent donc être apportés par l’alimentation. Chez l’Homme, cela concerne neuf acides aminés : l’histidine, l’isoleucine, la leucine, la lysine, la méthionine, la phénylalanine, la thréonine, le tryptophane et la valine.
Les acides aminés conditionnellement essentiels, également appelés acides aminés semi-essentiels, pour lesquels la production de l’acide aminé par l’organisme est normalement suffisante, mais qui, dans certaines circonstances, ne peuvent répondre aux besoins, de sorte qu’une supplémentation alimentaire devient nécessaire. Cela peut être le cas lors de périodes de croissance rapide (nourrissons), de grossesse, de maladie ou de traumatisme. Les besoins alimentaires spécifiques en acides aminés dépendent d’un certain nombre de facteurs, dont le stade de développement, la génétique, l’état physiologique, le microbiote intestinal, les conditions environnementales et les conditions pathologiques. Cependant, selon les sources, six acides aminés sont généralement considérés comme appartenant à cette catégorie : l’arginine, la cystéine, la glutamine, la glycine, la proline et la tyrosine.
-
Les acides aminés non essentiels qui sont normalement produits en quantités suffisantes par l’organisme. Les 5 acides aminés suivants sont souvent inclus dans cette catégorie : l’alanine, l’asparagine, l’acide aspartique, l’acide glutamique et la sérine.
La classification des acides aminés n’est pas tout à fait claire dans la littérature scientifique. Par exemple, l’histidine est qualifiée d’essentielle dans certaines sources, alors que dans d’autres, elle est décrite comme semi-essentielle. La classification ci-dessus est celle que l’on retrouve généralement dans les publications spécialisées. Les carences en acides aminés essentiels peuvent avoir de graves conséquences sur la santé et provoquer un large éventail de symptômes, reflétant les nombreuses fonctions différentes des acides aminés dans l’organisme.
Par exemple, un apport insuffisant en acides aminés essentiels peut entraîner la dépression, l’anxiété, l’insomnie, l’épuisement, une réduction de la croissance et du développement mental chez les enfants.
Les 20 acides aminés standard
Dans ce qui suit, les 20 acides aminés sont présentés dans l’ordre alphabétique avec leurs formules structurelles telles qu’elles seraient au pH physiologique. Pour chaque acide aminé, les abréviations à trois lettres et à une lettre sont indiquées entre parenthèses, et l’accent est mis sur les principales propriétés et fonctions biologiques.
Alanine (Ala, A)
L’alanine est un acide aminé non essentiel qui joue un rôle central dans le métabolisme énergétique. Elle fait partie du cycle glucose-alanine, dans lequel les muscles et le foie travaillent ensemble pour équilibrer les besoins énergétiques et l’excrétion d’azote. Lorsque les muscles décomposent les acides aminés pendant l’exercice, de l’alanine est formée et transportée vers le foie où elle est utilisée pour produire du glucose. Ce mécanisme permet aux muscles de maintenir leur approvisionnement en énergie tout en évitant l’accumulation d’ammoniaque toxique (NH3).
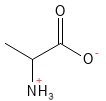
Figure 2 Formule structurelle de l’alanine
Arginine (Arg, R)
L’arginine est un acide aminé semi-essentiel pour l’être humain, notamment les nourrissons ; certaines maladies et le stress nécessitent un apport par l’alimentation. Pour certains groupes d’animaux comme les oiseaux, les chats et les chiens, l’arginine est essentielle. L’arginine est impliquée dans un grand nombre de processus, notamment la division cellulaire, la cicatrisation des plaies, la fonction immunitaire et la pression artérielle. C’est un précurseur de l’oxyde nitrique (NO), qui a un effet vasodilatateur et peut donc faire baisser la tension artérielle. L’arginine intervient également dans la formation de la créatine (une source d’énergie importante pour les muscles) et dans le cycle de l’urée qui élimine l’excès d’ammoniaque de l’organisme. Cliniquement, la supplémentation en arginine a montré des effets positifs sur la cicatrisation des plaies.
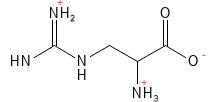
Figure 3 Formule structurelle de l’arginine, l’un des acides aminés basiques dont la chaîne latérale est chargée positivement. Cet acide aminé possède le plus d’atomes d’azote et peut en libérer deux par hydrolyse pour former de l’urée, qui est le moyen pour l’organisme d’excréter l’ammoniaque, un déchet toxique issu du métabolisme des protéines.
Asparagine (Asn, N)
L’asparagine est un acide aminé non essentiel qui joue un rôle majeur de transporteur d’azote dans le métabolisme et la synthèse des protéines. Elle est particulièrement importante pour le système nerveux, où elle joue un rôle essentiel dans le développement et le fonctionnement du cerveau.
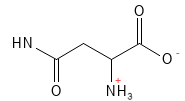
Figure 4 Formule structurelle de l’asparagine.
Acide aspartique (Asp, D)
L’acide aspartique et sa forme correspondante chargée négativement, l’aspartate, qui est la forme normale au pH physiologique, fait partie des acides aminés non essentiels. Il joue un rôle central dans le métabolisme énergétique et sert de précurseur à certains des nucléotides de l’ARN et de l’ADN et à plusieurs autres acides aminés tels que l’asparagine, la méthionine et la lysine. De plus, cet acide aminé est impliqué dans le cycle de l’urée et joue un rôle important dans l’énergie, la division cellulaire et la gestion de l’azote par l’organisme.
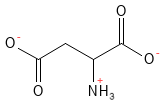
Figure 5 Formule structurelle de l’aspartate. Au pH physiologique, l’acide aspartique a cédé son atome H dans le groupe acide carboxylique de la chaîne latérale, ce qui lui confère une charge négative et lui vaut le nom d’aspartate.
Cystéine (Cys, C)
La cystéine est un acide aminé soufré qui peut être formé à partir de la méthionine, mais dans certaines conditions (par exemple chez les nourrissons ou en cas de maladie), elle peut nécessiter un apport supplémentaire par l’alimentation, ce qui en fait un acide aminé semi-essentiel.
Elle possède une propriété chimique particulière : deux molécules de cystéine peuvent former une liaison disulfure covalente. Ces liaisons agissent comme des « crochets moléculaires » qui stabilisent la structure tridimensionnelle des protéines – une caractéristique essentielle de la kératine de la peau, des cheveux et des ongles. La cystéine fait également partie du glutathion, un tripeptide antioxydant très important produit par la plupart des organismes consommateurs d’oxygène4.
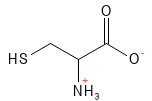
Figure 6 Formule structurelle de la cystéine. Grâce à son atome de soufre, elle peut former une liaison disulfure avec un autre acide aminé cystéine. Cette molécule composée de deux acides aminés est appelée cystine. La liaison disulfure entre deux molécules de cystéine est également importante dans la structure des protéines, par exemple dans la kératine.
Acide glutamique (Glu, E)
L’acide glutamique et sa forme correspondante chargée négativement, le glutamate, qui est la forme normale au pH physiologique, est un acide aminé non essentiel. Il a une importance particulière pour le cerveau où il agit comme neurotransmetteur et comme précurseur du neurotransmetteur GABA (acide gamma-aminobutyrique), un neurotransmetteur inhibiteur majeur. Le glutamate, comme la cysténine, fait partie du tripeptide antioxydant glutathion. Par ailleurs, le glutamate contribue à donner aux aliments une saveur umami.
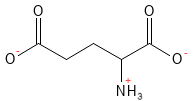
Figure 7 Formule structurelle du glutamate. Au pH physiologique, l’acide glutamique a cédé son atome H dans le groupe acide carboxylique de la chaîne latérale, ce qui lui confère une charge négative et lui vaut le nom de glutamate.
Glutamine (Gln, Q)
La glutamine fait partie des acides aminés semi-essentiels, car un traumatisme, une maladie ou la période de la petite enfance peuvent nécessiter plus que ce que l’organisme est capable de produire. Elle joue un rôle clé dans la régulation acido-basique de l’organisme, en particulier dans les reins. Elle est fondamentale pour la synthèse des lipides et des nucléotides. La glutamine est également un important transporteur d’azote entre les tissus et le foie, contribuant ainsi à évacuer l’ammoniaque hors des tissus.
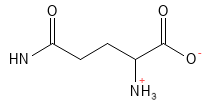
Figure 8 Formule structurelle de la glutamine.
Glycine (Gly, G)
La glycine est l’acide aminé le plus simple et le plus petit, ce qui la rend très flexible dans les structures protéiques. Elle fait partie des acides aminés semi-essentiels (bien que certains ouvrages la considèrent comme non essentielle) et joue un rôle très important dans l’organisme : par exemple, elle entre pour environ 35 % dans la composition du collagène. La glycine est également un neurotransmetteur du système nerveux central et fait partie du tripeptide antioxydant glutathion. Par ailleurs, la glycine apporte une saveur douce et sucrée, qui est utilisée dans la production de divers aliments.
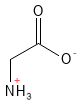
Figure 9 Formule structurelle de la glycine, le plus simple et le plus petit de tous les acides aminés.
Histidine (His, H)
L’histidine est généralement considérée comme un acide aminé essentiel, mais certaines publications la qualifient de semi-essentielle. Cet acide aminé est un précurseur de l’histamine, une substance messagère, qui joue un rôle central dans la réponse immunitaire, les réactions allergiques et en tant que neurotransmetteur. Comme l’arginine et la lysine, elle est chargée positivement au pH physiologique.
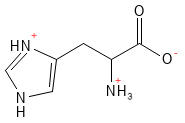
Figure 10 Formule structurelle de l’histidine, l’un des acides aminés basiques dont la chaîne latérale est chargée positivement.
Isoleucine (Ile, I)
L’isoleucine est un acide aminé essentiel et l’un des acides aminés dits à chaîne ramifiée (BCAA : Branched Chain Amino Acid), avec la leucine et la valine. Elle contribue au métabolisme énergétique des muscles et à la régulation de la glycémie. L’isoleucine joue aussi un rôle important dans l’hémoglobine, la protéine qui transporte l’oxygène dans le sang.
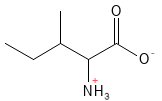
Figure 11 Formule structurelle de l’isoleucine, l’un des acides aminés à chaîne latérale ramifiée (dit BCAA).
4Pour en savoir plus sur les antioxydants, consultez le site
Leucine (Leu, L)
La leucine est un acide aminé essentiel et l’un des trois acides aminés à chaîne ramifiée (BCAA : Branched Chain Amino Acid). Elle est particulièrement importante pour le tissu musculaire car elle stimule la synthèse des protéines et inhibe la dégradation des protéines musculaires. La leucine joue également un rôle dans la régulation de la glycémie. Elle agit aussi comme exhausteur de goût naturel dans les aliments.
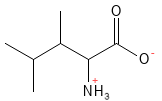
Figure 12 Formule structurelle de la leucine, l’un des acides aminés à chaîne latérale ramifiée (dit BCAA).
Lysine (Lys, K)
La lysine fait partie des acides aminés essentiels et c’est l’un des trois acides aminés chargés positivement au pH physiologique. Elle joue un rôle central dans plusieurs processus vitaux. Par exemple, elle est nécessaire à la formation du collagène, elle est impliquée dans le métabolisme des acides gras et dans la régulation épigénétique de l’expression des gènes par le biais de modifications chimiques des histones5. Elle favorise aussi l’absorption du calcium.
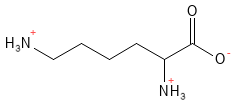
Figure 13 Formule structurelle de la lysine, l’un des acides aminés basiques dont la chaîne latérale est chargée positivement.
Méthionine (Met, M)
La méthionine est un acide aminé essentiel contenant du soufre qui sert de précurseur à plusieurs autres biomolécules. Elle est notamment un précurseur pour la formation de la cystéine et de la S-adénosylméthionine (SAM-e), un important donneur de méthyle dans de nombreuses réactions biochimiques, y compris la méthylation6 de l’ADN et des protéines. La méthionine a été utilisée dans le traitement des maladies du foie et de la dépression, et une carence peut entraîner une perte de couleur des cheveux.
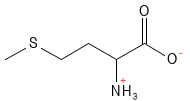
Figure 14 Formule structurelle de la méthionine.
Phénylalanine (Phe, F)
La phénylalanine est un acide aminé essentiel qui joue un rôle important en tant que précurseur de la tyrosine. À partir de là, plusieurs substances messagères importantes peuvent se former, notamment la dopamine, l’adrénaline et la noradrénaline, ainsi que le pigment de la mélanine, qui contribue à la couleur de la peau et à la protection contre les rayons du soleil. La phénylalanine est utilisée dans le traitement de la dépression et de la douleur chronique.
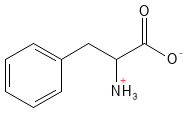
Figure 15 Formule structurelle de la phénylalanine.
Proline (Pro, P)
La proline est un acide aminé non essentiel et inhabituel, car sa chaîne latérale forme une structure en anneau avec le groupe amino lui-même, ce qui lui confère un rôle particulier dans la structure des protéines. Cet acide aminé est capital pour la formation du collagène, la proline et l’hydroxyproline constituant une partie essentielle de la structure du collagène.
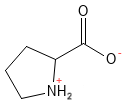
Figure 16 Formule structurelle de la proline. Notez comment la chaîne latérale forme une structure en anneau à cinq chaînons avec le groupe amine, qui devient ainsi une amine secondaire. Par rapport aux autres acides aminés, la proline est plus rigide.
Sérine (Ser, S)
La sérine est un acide aminé non essentiel qui a été isolé pour la première fois dans la soie, particulièrement riche en ce composé. Elle joue un rôle important dans le fonctionnement du cerveau et participe à la synthèse des nucléotides, qui sont les éléments constitutifs de l’ADN et de l’ARN. La sérine est également un précurseur d’autres acides aminés, dont la glycine et la cystéine, et participe à la biosynthèse du folate (la vitamine B9).
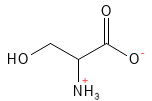
Figure 17 Formule structurelle de la sérine.
Thréonine (Thr, T)
La thréonine est un acide aminé essentiel et le dernier des 20 acides aminés standard à avoir été découvert (en 1935). Elle participe à la formation du collagène et de l’élastine, ce qui indique son importance pour la structure de la peau et du tissu conjonctif.
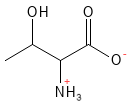
Figure 18 Formule structurelle de la thréonine.
Tryptophane (Trp, W)
Le tryptophane est un acide aminé essentiel connu pour son rôle de précurseur de plusieurs molécules biologiquement actives. Il est notamment transformé en neurotransmetteur, la sérotonine, qui régule l’humeur et le sommeil, et en hormone, la mélatonine, qui contrôle le rythme circadien. Le tryptophane est également une source de niacine, la vitamine B3.
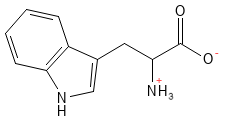
Figure 19 Formule structurelle du tryptophane, le plus grand des 20 acides aminés standard.
Tyrosine (Tyr, Y)
La tyrosine est un acide aminé non essentiel car elle peut se former à partir de la phénylalanine. Elle est biologiquement très importante car c’est un précurseur d’un certain nombre de substances messagères et d’hormones, dont le neurotransmetteur dopamine, qui peut être converti en hormones noradrénaline (norépinéphrine) et adrénaline (épinéphrine). La tyrosine intervient également dans la formation d’hormones métaboliques importantes produites par la glande thyroïde et dans la formation du pigment mélanique, la phéomélanine, qui donne la couleur à la peau et aux cheveux, et contribue à la protection contre les rayons du soleil.
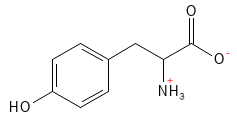
Figure 1 Formule structurelle de la tyrosine.
Valine (Val, V)
La valine est un acide aminé essentiel et l’un des trois acides aminés à chaîne ramifiée (BCAA : Branched Chain Amino Acid). Elle joue un rôle dans la régulation de la glycémie, l’équilibre énergétique et le métabolisme musculaire, où elle a un effet stimulant sur la synthèse des protéines.
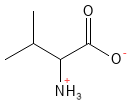
Figure 21 Formule structurelle de la valine, l’un des acides aminés à chaîne latérale ramifiée (dit BCAA).
5Les histones sont des protéines spéciales autour desquelles l’ADN est replié et qui participent à la régulation des gènes.
6La méthylation est le processus d’ajout d’un groupe méthyle (-CH3) à une molécule. Par exemple, ce processus est important dans la régulation de l’expression des gènes, c’est-à-dire la régulation épigénétique.
Acides aminés et biologie de la peau
Les acides aminés jouent un rôle central dans la structure et la fonction de la peau. Ils sont les éléments constitutifs de toutes les protéines telles que l’élastine et le collagène, qui constituent les structures protéiques fondamentales de la peau et contribuent à sa résistance, à son élasticité, à la cicatrisation des plaies, etc. La peau contient également des peptides antimicrobiens (AMP), qui constituent un élément clé du système immunitaire de la peau, régulant son microbiome et sa défense contre les micro-organismes étrangers.
Une part importante de l’équilibre hydrique de la peau est maintenue par ce que l’on appelle les facteurs naturels d’hydratation (NMF), dont les acides aminés et leurs dérivés représentent environ 40 %. Les NMF consistent en un mélange de sels, d’urée, d’électrolytes et d’acides aminés provenant principalement de la dégradation des protéines de la filaggrine7. Parmi les acides aminés des NMF, la sérine (environ 36 %), la glycine (22 %) et l’alanine (13 %) sont particulièrement abondantes, mais l’arginine joue également un rôle. La composition peut varier d’une zone à l’autre de la peau. Par exemple, la teneur en sérine est plus faible dans la joue et la mâchoire.
Outre leur rôle dans les NMF, il a été démontré que les acides aminés et certains petits peptides influencent plus directement la biologie de la peau.
Des études suggèrent que la consommation d’acides aminés ou de peptides spécifiques peut favoriser la synthèse du collagène, la cicatrisation des plaies et même augmenter l’hydratation et l’élasticité de la peau. Par exemple, il a été démontré que certains peptides stimulent la production d’acide hyaluronique dans les kératinocytes, tandis qu’une supplémentation orale en dipeptides de glycine et de leucine a amélioré l’hydratation de la peau après une exposition aux UVB dans le cadre d’études animales.
Dans les produits cosmétiques, les acides aminés et leurs sels sont utilisés à la fois comme ingrédients hydratants et pour fabriquer d’autres ingrédients. Les acides aminés sont généralement produits par fermentation, catalyse enzymatique ou hydrolyse des protéines, tandis que certains, comme la glycine, peuvent aussi être synthétisés chimiquement.
Les acides aminés sont bien plus que les éléments constitutifs des protéines. Ils sont essentiels à la croissance, au développement et aux processus biochimiques de l’organisme, tout en jouant un rôle clé dans la structure et la fonction de la peau.
7La filaggrine est une protéine importante de l’épiderme (la couche la plus externe de la peau) qui joue un rôle crucial dans sa fonction de barrière, son pH et sa capacité à retenir l’humidité. Pour en savoir plus sur la filaggrine, consultez le site
Sources :
- Akram, M. et. Al. Amino acids: A review article. Journal of Medicinal Plants Research, 2011; 5(17), 3997–4004.
- Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002. From RNA to Protein. Lokaliseret 22. August 2025: https://www.ncbi.nlm.nih.gov/books/NBK26829/.
- Arezki, N.R.; Williams, A.C.; Cobb, A.J.; & Brown, M.B. Design, synthesis and characterization of linear unnatural amino acids for skin moisturization. International Journal of Cosmetic Science. 2017; 39(1):72-82.
- CIR Expert Panel. Safety assessment of alpha-amino acids. International Journal of Toxicology, 2013; 32(6 Suppl), 59S–123S.
- Diaz I, Namkoong J, Wu J, Giancola G. Amino acid complex (AAComplex) benefits in cosmetic products: In vitro and in vivo clinical studies. Journal of Cosmetic Dermatology, 2022; 21:3046–3052.
- Fluhr, J.W.; Darlenski, R.; & Surber, C. Glycerol and the skin: holistic approach to its origin and functions. The British journal of dermatology. 2008; 159(1): 23-34.
- Gad, M. Z. Anti-aging effects of l-arginine. Journal of Advanced Research, 2010; 1(3), 169–177.
- Kamble, C.; Chavan, R.; & Kamble, V. A review on amino acids. Research & Reviews: A Journal of Drug Design and Discovery, 2022; 9(1), 1–10.
- Lopez, M.J.; & Mohiuddin, S.S. Biochemistry, Essential Amino Acids. [Updated 2024 Apr 30]. I: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. Lokaliseret 22. August 2025.
- Murakami, H.; Shimbo, K.; Inoue, Y.; Takino, Y.; & Kobayashi, H. Importance of amino acid composition to improve skin collagen protein synthesis rates in UV-irradiated mice. Amino Acids. 2012; 42(6):2481-2489.
- National Institute of General Medical Sciences. (2011, October 27). The structures of life. Chapter 1: Proteins are the body’s worker molecules.S. Department of Health & Human Services. Lokaliseret 22. August 2025: https://especialidades.sld.cu/histologia/files/2020/06/Booklet-The-Structures-of-Life.pdf.
- Nelson, D. L., & Cox, M. M. Lehninger Principles of Biochemistry (7th ed.). W. H. Freeman and Company; 2017.
- Nie, C., He, T., Zhang, W., Zhang, G., & Ma, X. Branched chain amino acids: Beyond nutrition metabolism. International Journal of Molecular Sciences, 2018; 19(4), 954.
- Nishiguchi, A., Matsumura, T., & Yoshikawa, M. Oral administration of glycine and leucine dipeptides improves skin hydration and elasticity in UVB-irradiated mice. Biomolecules & Therapeutics, 2017; 25(5), 528–534.
- PubChem Sketcher V2.4. Lokaliseret 11. September 2025: https://pubchem.ncbi.nlm.nih.gov
- Wikipedia websites: Amino acid; Aminosyre; Essential amino acid; Alanine; Arginine; Asparagine; Aspartic acid; Cysteine; Glutamine; Glutamic acid; Glycine; Histidine; Isoleucine; Leucine; Lysine; Methionine; Phenylalanine; Proline; Serine; Threonine; Tryptophan; Tyrosine; Valine. Lokaliseret 20. August 2025.
- Wu, G. Functional amino acids in nutrition and health. Amino Acids, 2013; 45(3), 407–411.
