Collagène
Le collagène est une protéine produite naturellement dans le corps, et constitue la base de notre peau, de nos cheveux et de nos os.
Il garantit que notre peau reste saine, jeune et repulpée. Parce qu’il se forme naturellement dans notre corps, la production de collagène commence à décliner à mesure que nous vieillissons. D’autres facteurs, tels que l’exposition au soleil, le tabagisme ou la consommation de sucre, contribuent également à la perte du collagène. Cette perte de collagène se traduira par l’apparition de ridules et de rides ainsi que par une peau moins pulpeuse et plus terne.
Notre sérum au collagène stimule la production de collagène et donne à votre peau une apparence plus lisse et plus pulpeuse.
Le sérum au collagène peut être utilisé en combinaison de tous nos autres sérums.
Nous utilisons le collagène BioStine HP (f) de la société Bio-Nest basée à Taïwan. Le collagène BioStine HP (f) provient d’écailles de poisson qui contiennent principalement du collagène de type I. Cette matière première se compose de collagène hydrolysé et de polysaccharide d’Euglena gracilis qui sont des glucides complexes de l’algue Euglena gracilis.
PRODUITS AU COLLAGÈNE
TOUT CE QUE VOUS DEVEZ SAVOIR
À PROPOS DU COLLAGÈNELe collagène fait référence à un groupe de 28 protéines différentes, et il s’agit de la protéine la plus courante dans le règne animal. Le collagène est apparu il y a très longtemps chez les animaux. On a par exemple trouvé du collagène intact dans des fossiles de Tyrannosaurus rex vieux de 68 millions d’années. Dans le corps humain, le collagène représente environ 30 % de la masse protéique totale et environ 75 % du poids sec de la peau correspond au collagène. Le collagène se trouve principalement dans le tissu conjonctif, par exemple dans les os, le cartilage, les tendons, les articulations et la peau.
Les 28 types de collagène sont désignés par le chiffre romain selon leur ordre de découverte. Il y a, par exemple le collagène I (découvert en premier), le collagène II, le collagène III, etc. Ils peuvent être divisés en 8 familles. Les collagènes I et III appartiennent par exemple aux collagènes fibrillaires, tandis que le collagène XIII par exemple appartient aux collagènes transmembranaires. Le point commun à tous les collagènes, soit ce qui définit une molécule de collagène, est une structure spéciale de la molécule appelée triple hélice, qui se compose de trois trames de chaînes d'acides aminés (peptides) qui s’enroulent les unes autour des autres et forment une structure très stable. Ce qui différencie principalement les 28 types de collagène, ce sont les autres segments (domaines) qui se trouvent dans les structures de protéines et les structures tridimensionnelles qu’ils forment. La structure en hélice triple forme ainsi une partie plus ou moins grande des différents collagènes. Le collagène I par exemple se compose de 96 % de structure en hélice triple, alors qu’elle est inférieure à 10 % dans le collagène XII.
PROPRIÉTÉS DU COLLAGÈNE DANS LA PEAU
Dans la peau, 70 à 90 % du collagène est de type I, tandis que 10 à 20 % est de type III. Les collagènes de type V, VII et XVII sont présents en plus petites quantités. On les trouve surtout dans la matrice extracellulaire (entre les cellules) avec d’autres substances telles que l’élastine et les glycosaminoglycanes (comme les hyaluronates et le sulfate de dermatane), où ils donnent de la structure et de l’élasticité à la peau. Le collagène est également important dans le processus de cicatrisation. Dans la maladie du scorbut par exemple, on constate des symptômes tels que le saignement des gencives et des difficultéss de cicatrisation car la carence en vitamine C empêche la formation correcte de collagène, étant donné que la vitamine C est un cofacteur important pour certaines enzymes qui jouent un rôle décisif dans la formation de la triple hélice du collagène. Un grand nombre d’autres maladies sont également causées par des défauts de formation du collagène ou des mutations directes sur les gènes du collagène.
QU’ARRIVE-T-IL AU COLLAGÈNE LORSQUE LA PEAU VIEILLIT ?
Le renouvellement du collagène est assez précisément contrôlé et varie avec l’âge. Le collagène et l’élastine sont des protéines assez stables, dont la demi-vie se mesure en années. Chaque molécule est donc exposée à un certain nombre de contrainte au cours de sa vie et elle accumule continuellement de petits dommages dans sa structure, ce qui altère sa fonction. Les métalloprotéinases matricielles (MMP) sont les enzymes qui déclenchent la dégradation du collagène. Les collagènes I, II et III par exemple sont coupés par MMP-1, MMP-8 et MMP-13, après quoi d’autres enzymes continuent de dégrader les composants du collagène. L’activité des enzymes MMP est liée aux rayons UV et au stress oxydatif de la peau causé par les radicaux libres. En vieillissant, la production et la qualité du collagène de la peau diminuent. La teneur en collagène culmine vers l’âge de 30 ans, puis la quantité diminue d’environ 1 à 1,5 % par an, tout comme ses composants extracellulaires associés, de sorte qu’à l’âge de 70 ans environ, la quantité est d’environ 25 % de ce qu’elle a été à son maximum. La diminution de la teneur en collagène et de la qualité du collagène est corrélée avec le vieillissement de la peau, par exemple les rides.
LA BIOSYNTHÈSE DU COLLAGÈNE
Les protéines sont toutes synthétisées de la même manière : Les protéines sont synthétisées à partir de l’information génétique contenue dans l’ADN. En bref, un gène, portion de l’ADN est « ouvert » (après l’arrivée d'un signal) afin qu’il puisse être copié (transcrit) en une molécule d’ARN appelée ARN messager (ARNm). Cela se passe à l’intérieur du noyau de la cellule. La molécule d’ARNm pénètre dans le cytoplasme de la cellule, où des unités spéciales appelées ribosomes traduisent le code de l’ARNm en acides aminés, qui sont assemblés pour former une chaîne peptidique, une longue chaîne d’acides aminés. Dans certains cas, celle-ci est légèrement modifiée (modification post-traductionnelle), après quoi elle est repliée en une structure tridimensionnelle spécifique, et éventuellement combinée à d’autres chaînes peptidiques pour former la protéine finale. Ainsi, les protéines sont généralement de très grosses molécules qui peuvent être constituées de plusieurs chaînes peptidiques.
Dans la description suivante de la synthèse du collagène et de sa structure, nous traiterons le cas du collagène I, qui est le collagène le plus courant dans la peau.
Les fibroblastes sont les cellules cutanées du derme qui produisent la majeure partie du collagène de type I de la peau. À la surface de la cellule, il existe un grand nombre de récepteurs, dont certains peuvent se lier à des molécules de signal, ce qui conduit à l’activation de la cellule et déclenche le processus de production de collagène. À l’intérieur du noyau de la cellule, les gènes spécifiques des trois chaînes peptidiques sont transcrits en ARNm, qui est ensuite conduit dans le cytoplasme de la cellule, où ils sont traduits via les ribosomes en acides aminés, qui sont assemblés pour former des chaînes peptidiques.
Chaque chaîne peptidique est constituée de 1 050 acides aminés et pour le collagène de type I, elle est constituée de deux chaînes alpha-1(I) et d’une chaîne alpha-2(I) (les autres collagènes sont constitués de trois chaînes identiques ou de trois chaînes différentes). La particularité du collagène est que la séquence des acides aminés qui se répète généralement tout au long de la chaîne est glycine-X-Y, où X et Y sont généralement les acides aminés proline et hydroxyproline. C’est cette séquence d’acides aminés qui est décisive pour la formation de l’importante structure en triple hélice. Les chaînes peptidiques sont conduites directement dans un organite du système membranaire appelé réticulum endoplasmique, où les trois chaînes peptidiques du procollagène subissent un certain nombre de processus (modifications post-traductionnelles), notamment la glycosylation, où certaines molécules de sucre sont placées à certains endroits, l’hydroxylation de certaines prolines et lysines, et enfin des liaisons disulfures entre les trois chaînes, qui les figent dans leur dans leur fameuse forme de triple hélice droite. Ensuite, ce procollagène est conduit hors de la cellule par une vésicule, et des enzymes extracellulaires coupent ses extrémités. Il en résulte une structure appelée tropocollagène, qui pour le collagène I consiste essentiellement en une hélice triple, qui mesure 300 nm de long et environ 1,5 nm de diamètre. Cette suppression des extrémités signifie que la molécule peut former des liaisons (crosslinks) avec d’autres hélices triples de collagène I et former ainsi des structures plus grandes appelées fibrilles de collagène, qui ont une structure particulière qui apparaît en microscopie électronique sous la forme d’une structure rayée. Les fibrilles de collagène I ont un diamètre de 50 à 200 nm. Les fibrilles peuvent ensuite s’assembler en structures fibreuses encore plus grandes de collagène I, qui dans les tendons par exemple mesurent jusqu’à 1 cm de long et 500 nm de diamètre.
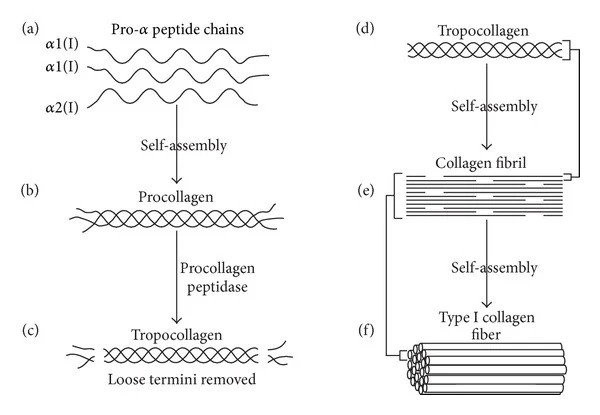
Figure 1. Biosynthèse du collagène I : (a) Deux chaînes peptidiques alpha-1(I) et une chaîne peptidique alpha-2(I) identiques s'assemblent pour former du procollagène (b). (c) L’enzyme procollagène peptidase élimine les extrémités « libres » pour former ainsi le tropocollagène (d). La molécule de tropocollagène s’assemble avec d’autres tropocollagènes et forme ainsi une ou plusieurs fibrilles de collagène I en croissance. Ensemble, ces fibrilles de collagène peuvent alors former la fibre de collagène I (f). Cette figure est tirée de l’article « Collagen Scaffolds in Bone Sialoprotein-Mediated Bone Regeneration » de Kruger, TE ; Miller, AH; Wang, J. Publié dans The Scientific World Journal, volume 2013, article ID 812718, 6 pages, 2013.
LE COLLAGÈNE DANS LES COSMÉTIQUES
Le collagène est une structure très volumineuse et insoluble, qui ne pourra pas traverser la peau ; mais il peut former un film (structure cohésive) qui réduit la perte d’eau de la peau et agit ainsi comme un agent de rétention d’humidité, aussi parce que le collagène peut se lier à l’eau.
Dans de nombreux cas, on utilise du collagène hydrolysé dans les cosmétiques, qui a généralement d’abord été dénaturé puis décomposé par voie enzymatique en parties plus petites, dont la taille et la capacité à pénétrer la peau peuvent varier considérablement. Par exemple, il a été montré que certains hydrolysats de collagène possèdent des propriétés antioxydantes et hydratantes et des propriétés réparatrices pour les peaux abîmées.
Il existe plusieurs sources naturelles de collagène : les porcs, les bovins et les animaux marins tels que les poissons. Le collagène bovin est facilement disponible et utile à certaines fins biomécaniques, mais malheureusement assez hétérogène. Il peut également être immunogène (peut provoquer une réaction immunitaire) et perdre son intégrité structurelle au cours du processus d’isolement. Avec le collagène de porc, il existe un risque de maladies zoonotiques, telles que l’ESB (encéphalopathie spongiforme bovine, c’est-à-dire la maladie de la vache folle). Le collagène d’origine marine est moins stable à la chaleur mais possède des propriétés qui le rendent intéressant dans un contexte cosmétique. Comme pour les autres sources naturelles, il existe un risque de variations d’un lot à l'autre qui peut être difficile à contrôler.
Une autre façon de procéder consiste à synthétiser en laboratoire des peptides plus petits avec la même séquence d’acides aminés ou une séquence similaire à celle du collagène. Il peut s'agir de petits dipeptides ou tripeptides (constitués de deux ou trois acides aminés) ou de structures plus grandes pouvant former une triple hélice comme ceux du collagène. Une autre manière consiste à produire des cellules génétiquement modifiées (par exemple des cellules d’orge ou de tabac), capables de produire du collagène dans des conditions plus contrôlées.
L’UTILISATION DU COLLAGÈNE
En plus de son utilisation en cosmétique, le collagène est utilisé dans de nombreux autres contextes, par exemple comme produits de remplissage, où une petite quantité de collagène est injectée dans la peau pour corriger les rides par exemple, et dans des contextes médicaux pour la cicatrisation des plaies. Le collagène est également disponible sous forme de compléments alimentaires (généralement associé à un certain nombre de vitamines et d’autres substances naturelles), dont le but est d’améliorer la structure de la peau. Des études montrent que les compléments alimentaires très complets incluant du collagène ont des effets sur la peau. La théorie sous-jacente est qu’après ingestion, le collagène est décomposé dans l’estomac principalement en acides aminés et environ 10 % deviennent de petits dipeptides et tri-peptides qui sont absorbés dans le sang et distribués dans tout le corps, par exemple dans la peau, où les cellules peuvent utiliser les acides aminés comme « blocs de construction » pour synthétiser du collagène. Des études montrent que les dipeptides contenant de l’hydroxyproline peuvent stimuler les fibroblastes via des récepteurs et ainsi induire la synthèse de collagène.
SOURCES:
Aguirre-Cruz, G.; León-López, A.; Cruz-Gómez ,V.; Jiménez-Alvarado, R., Aguirre-Álvarez, G. Collagen Hydrolysates for Skin Protection: Oral Administration and Topical Formulation. Antioxidants (Basel). 2020 Feb 22;9(2):181.
Avila Rodríguez, M. I.; Rodríguez Barroso, L.G.; Sanchez, M. L. Collagen: A review on its sources and potential cosmetic applications. Journal of Cosmetic Dermatology 2018; 17: 20-26.
Kruger, T. E.; Miller, A. H.; Wang, J. Collagen Scaffolds in Bone Sialoprotein-Mediated Bone Regeneration. The Scientific World Journal, vol. 2013, Article ID 812718, 6 pages, 2013
Lodish, H., Berk, A.; Zipursky, S.L., et al. Molecular Cell Biology. 4th edition. New York: W. H. Freeman; 2000. Section 22.3, Collagen: The Fibrous Proteins of the Matrix.
Lokaliseret 19. Juli 2021: https://www.ncbi.nlm.nih.gov/books/NBK21582
Reilly, D.M.; Lozano, J. Skin collagen through the lifestages: importance for skin health and beauty. Plastic and Aesthetic Research 2021; 8:2.
Ricard-Blum, S. The collagen family. Cold Spring Harbor perspectives in biology. 2011 Jan 1;3(1):a004978.
Shoulders, M.D.; Raines, R.T. Collagen structure and stability. Annual review of biochemistry, 2009, vol. 78, 929–958.
Sionkowska, A.; Adamiak, K.; Musiał, K.; Gadomska, M. Collagen Based Materials in Cosmetic Applications: A Review. Materials 2020, 13, 4217.




